在微生物的世界里,细菌和噬菌体之间的斗争犹如一场没有硝烟的“军备竞赛”绵延至今,它们相互拮抗,在漫长的进化历程中不断演变。为了抵御噬菌体的侵染,细菌进化出多种抗噬菌体防御系统如CRISPR-Cas系统等,而反过来,噬菌体“魔高一丈”,编码众多以Anti-CRISPR(Acr)蛋白为代表的反防御蛋白。2023年2月,我校冯越课题组曾与加州大学旧金山分校Joseph Bondy-Denomy课题组合作在Cell杂志发文报道噬菌体反防御蛋白Acb2(Anti-CBASS2)的发现及其作为海绵蛋白吸附信号分子的机制。2024年10月30日,冯越课题组与Joseph Bondy-Denomy课题组再次合作,在Nature在线发表了题为Single phage proteins sequester signals from TIR and cGAS-like enzymes的研究论文,揭示Tad1和Tad2与Acb2均为具有两种不同的结合口袋的“超级海绵”,从而将目前发现的仅有的三个噬菌体海绵蛋白均统一为多结合口袋的“超级海绵”,建立了海绵蛋白研究的新范式。

冯越组首先通过体外生化实验对Tad1及Tad2结合其他多种环状寡核苷酸的能力进行验证,发现二者除了对1′′-2′-gcADPR/1′′-3′-gcADPR有结合作用外,还能结合多种环二或环三核苷酸。为了揭示Tad蛋白结合信号分子的机制,冯越组解析了Tad蛋白与多种环状寡核苷酸的复合物晶体结构。他们发现Tad1蛋白以六聚体形式存在,而不是之前报道的二聚体,Tad1像一个拥有两个“隔离舱”的“分子飞船”,能形成两个独立口袋隔离两个CTN,同时Tad1还使用与 gcADPR 分子相同的结合口袋隔离 CDN。而Tad2 则是一个四聚体,可同时与两个 CDN 和两个 gcADPR 分子结合(图1)。此外,冯越组通过定量分析Tad蛋白与环状寡核苷酸的结合亲和力,发现Tad1对于常见的CBASS防御系统信号分子如cA3、2′,3′-cGAMP,3′,3′-cGAMP等均有较强的结合亲和力,而Tad2并不结合CTNs,仅结合CDNs。更有意思的是,他们发现Tad2的一个homolog(HgmTad2)对cGG的结合亲和力高达24 pM,是目前已报道的亲和力最强的cGG结合蛋白,也远高于目前报道的海绵蛋白对信号分子的亲和力。在细菌中,cGG是最广泛的 CDN,它像一个“关键枢纽”参与调节细菌生长和行为包括运动、毒力、生物膜形成和细胞周期进程等多个方面。HgmTad2是首个发现的靶向cGG的噬菌体反防御蛋白,有望为未来研究cGG相关的信号转导通路提供思路。随后,Bondy-Denomy课题组通过抗噬菌体实验验证了Tad蛋白具有抑制CBASS系统以及Thoeris系统的体内活性。
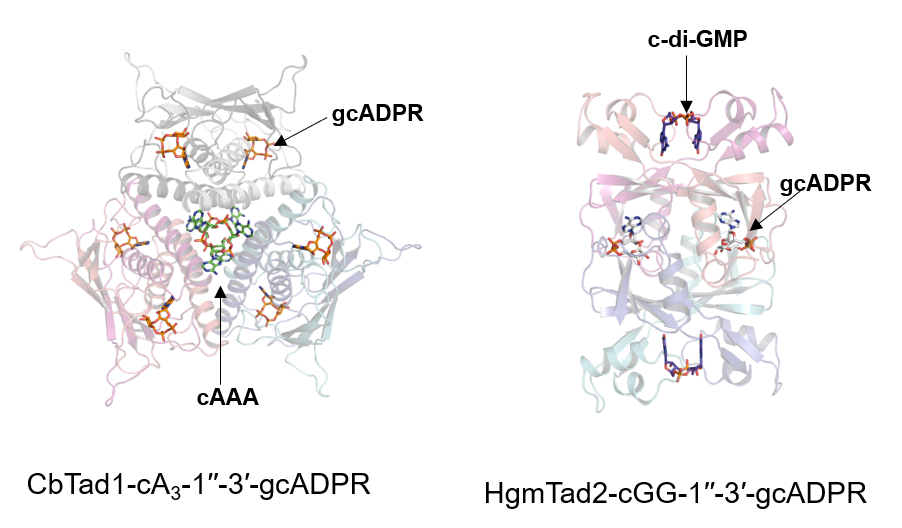
图1 CbTad1-cA3-1′′-3′-gcADPR及HgmTad2-cGG-1′′-3′-gcADPR结构展示
综上,该论文以及冯越课题组针对Acb2的系列工作证实了目前已知的仅有的三种海绵蛋白, Acb2,Tad1,Tad2均为具有多个结合位点隔离信号分子的“超级海绵”,这一发现暗示具有多个信号分子结合位点的反防御蛋白可能广泛存在,从而建立了噬菌体反防御“海绵蛋白”研究的新范式。
北京化工大学大学博士研究生李栋、中国科学院植物研究所肖裕、加州大学旧金山分校Iana Fedorova博士,北京化工大学博士研究生熊伟佳,硕士研究生王宇及已毕业博士生刘茜为本文的共同第一作者,北京化工大学冯越教授与加州大学旧金山分校Joseph Bondy-Denomy教授为本文的共同通讯作者。北京化工大学为第一单位。
原文链接:https://www.nature.com/articles/s41586-024-08122-4
冯越教授简介
冯越,北京化工大学教授,博士生导师,国家优秀青年基金获得者(2018)。主要以生物化学与分子生物学、结构生物学、细胞生物学等为手段,对微生物与宿主免疫系统相互作机制开展研究。共发表SCI论文53篇,其中通讯作者(含共同)论文30篇,分别发表在Nature(2篇)、Cell、Mol Cell (3篇)、Nat Chem Biol (3篇)、PNAS、Nat Plants、Nat Commun (2篇)、Nucleic Acids Res等国际著名期刊。作为负责人主持国家及省部级项目多项。曾获得青年北京学者(2024)、全国青年岗位能手(2020)、北京市优秀青年人才(2020)、北京市科学技术进步奖二等奖(2018)、中国十大新锐科技人物(2018)、北京市科技新星(2019)等荣誉。